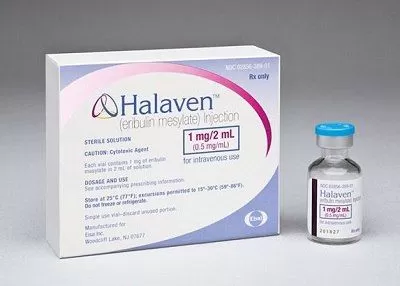
Противоопухолевый препарат.
Раствор для в/в введения прозрачный, бесцветный.
В 1 мл раствора содержится:
Активное вещество: арибулин - 0.5 мг;
вспомогательные вещества: этанол - 0.05 мл, хлористоводородная кислота и натрия гидроксид - до pH 6.0-9.0, вода д/и - до 1 мл.
2 мл - флаконы бесцветного стекла (1) - пачки картонные.
2 мл - флаконы бесцветного стекла (6) - пачки картонные.
Халавен показан пациентам:
— с местно-распространенным или метастатическим раком молочной железы, получившим ранее не менее одного режима химиотерапии по поводу распространенного заболевания. Предшествующая терапия должна включать антрациклины и таксаны в адьювантном режиме или в условиях метастатической формы заболевания за исключением тех пациентов, которым не могли назначаться данные препараты;
— с неоперабельной липосаркомой, получившим ранее химиотерапию антрациклинами по поводу распространенного или метастатического заболевания (за исключением тех пациентов, которым не могли назначаться данные препараты).
— гиперчувствительность к эрибулину или какому-либо из вспомогательных веществ;
— беременность
— период грудного вскармливания;
— возраст до 18 лет.
С осторожностью
Синдром врожденного удлинения интервала QT.
Заболевания сердца (сердечная недостаточность, брадиаритмия).
Электролитный дисбаланс (например, гипокалиемия, гипомагниемия).
Одновременный прием лекарственных средств, удлиняющих интервал QT (в т.ч. антиаритмических I A и III классов).
Одновременный прием лекарственных средств, обладающих узким терапевтическим диапазоном и метаболизирующихся преимущественно изоферментом СYP3А4 (см. раздел «Лекарственное взаимодействие»).
Тяжелая печеночная недостаточность и нарушение функции печени, связанное с циррозом (применение препарата у данной группы пациентов не изучалось).
Почечная недостаточность средней и тяжелой степени тяжести (см. раздел «Дозировка»).
Внутривенно.
Лечение препаратом Халавен следует проводить только под контролем врача, имеющего соответствующий опыт применения цитотоксических лекарственных препаратов.
Противорвотные средства и ГКС рекомендуются в случае возникновения у пациента тошноты и рвоты.
Рекомендуемая доза препарата Халавен составляет 1.4 мг/м2. Данная доза вводится внутривенно в течение 2-5 минут в 1-й и 8-й дни каждого 21-дневного цикла.
Применение у пациентов с печеночной недостаточностью
Нарушение функции печени, связанное с образованием метастазов
Рекомендуемая доза препарата Халавен для пациентов с легкой печеночной недостаточностью (класс А по Чайлд-Пью) составляет 1.1 мг/м2 внутривенно в течение 2-5 минут в 1-й и 8-й дни 21-дневного лечебного цикла
Рекомендуемая доза препарата Халавен для пациентов с печеночной недостаточностью средней степени тяжести (класс В по Чайлд-Пью) составляет 0.7 мг/м внутривенно в течение 2-5 минут в 1-й и 8-й дни 21-дневного цикла терапии.
Применение препарата Халавен у пациентов с тяжелой печеночной недостаточностью (класс С по Чайлд-Пью) не изучалось, но ожидается, что может потребоваться более значительное снижение дозы препарата Халавен.
Нарушение функции печени, связанное с циррозом
Применение препарата у данной группы пациентов не изучалось. Вышеприведенные дозы могут применяться для пациентов с печеночной недостаточностью легкой и средней степени тяжести, при условии тщательного мониторинга, т.к. может потребоваться дальнейшее снижение дозы.
Применение у пациентов с почечной недостаточностью
У некоторых пациентов с почечной недостаточностью средней или тяжелой степени тяжести (КК < 50 мл/мин) может наблюдаться увеличение экспозиции эрибулина и как следствие может потребоваться снижение начальной дозы. Для всех пациентов с почечной недостаточность рекомендуются дополнительные меры предосторожности и мониторинг побочных явлений.
Применение у детей
Применение препарата у детей и подростков по показанию "рак молочной железы" не предусмотрено.
Безопасность и эффективность препарата Халавен у пациентов моложе 18 лет с саркомами мягких тканей к настоящему моменту не оценивалась.
Применение у лиц пожилого возраста
Специальных рекомендаций для лиц пожилого возраста по изменению дозы не предусмотрено
Инструкции по разведению препарата перед введением
Препарат Халавен разводят в асептических условиях не более чем в 100 мл 0.9% раствора натрия хлорида для инъекций. Препарат нельзя смешивать с другими лекарственными средствами, а также разводить в 5% растворе декстрозы.
Перед введением следует обеспечить хороший доступ к периферическим венам или к центральной вене. Халавен не оказывает раздражающего или некротизирующего действия в месте введения. В случае экстравазации лечение должно быть симптоматическим.
Инфекционные и паразитарные заболевания: инфекция мочевыводящих путей, пневмония, кандидоз полости рта, герпес слизистой оболочки полости рта, инфекция верхних дыхательных путей, назофарингит, ринит, опоясывающий лишай, сепсис, нейтропенический сепсис.
Нарушения со стороны крови и лимфатической системы: нейтропения, лейкопения, анемия, лимфопения, фебрильная нейтропения, тромбоцитопения, диссеминированное внутрисосудистое свертывание крови.
Нарушения обмена веществ и питания:снижение аппетита, гипокалиемия, гипомагниемия, обезвоживание, гипергликемия, гипофосфатемия.
Нарушения психики:бессонница, депрессия.
Нарушения со стороны нервной системы:периферическая невропатия, головная боль, дисгевзия, головокружение, гипестезия, летаргия, нейротоксичность.
Нарушения со стороны органа зрения: повышение слезоотделения, конъюнктивит.
Нарушения со стороны органа слуха и лабиринтные нарушения:вертиго, звон в ушах.
Нарушения со стороны сердца:тахикардия.
Нарушения со стороны сосудов:"приливы", тромбоэмболия легочной артерии, тромбоз глубоких вен.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения:диспноэ, кашель, орофарингеальная боль, носовое кровотечение, ринорея, интерстициальные заболевания легких.
Нарушения со стороны желудочно-кишечного тракта:тошнота, запор, диарея, рвота, боль в животе, стоматит, сухость ротовой полости, диспепсия, гастроэзофагеальная рефлюксная болезнь, вздутие живота, изъязвление слизистой оболочки ротовой полости, панкреатит.
Нарушения со стороны печени и желчевыводящих путей:повышение активности АСТ, повышение активности АЛТ, повышение активности ГГТ, гипербилирубинемия, гепатотоксичность.
Нарушения со стороны кожи и подкожных тканей:алопеция, сыпь, зуд, поражение ногтей, ночная потливость, сухость кожи, эритема, гипергидроз, ладонно-подошвенная эритродизестезия, ангионевротический отек.
Нарушения со стороны скелетно-мышечной и соединительной ткани:артралгия и миалгия, боль в спине, боль в конечностях, боль в костях, мышечный спазм, мышечно-скелетная боль и боль в груди, мышечная слабость.
Нарушения со стороны почек и мочевыводящих путей:дизурия, гематурия, протеинурия, почечная недостаточность.
Общие расстройства и нарушения в месте введения:утомляемость, астения, лихорадка, воспаление слизистых оболочек, периферический отек, боль, озноб, боль в груди, гриппоподобный синдром.
Лабораторные и инструментальные данные:снижение массы тела.
Дополнительная информация по некоторым побочным эффектам
Нейтропения
Наблюдавшаяся нейтропения была обратимой и некумулятивной. Среднее время до ожидаемого минимума числа нейтрофилов (надир) составляло 13 дней, а среднее время до восстановления после тяжелой нейтропении (АЧН < 0.5×109/л) составило 8 дней.
В исследовании EMBRACE снижение числа нейтрофилов до значений < 0.5×109/л, длящееся более 7 дней, встречалось в 13% случаев.
При саркомах мягких тканей нейтропения наблюдалась реже (37.4 % случаев), чем при раке молочной железы (57.9% случаев).
При тяжелой нейтропении по решению лечащего врача и в соответствии с действующими рекомендациями может быть назначен гранулоцитарный колониестимулирующий фактор (Г-КСФ) или его аналог.
Нейтропения приводила к прекращению участия в исследовании менее 1% пациентов, получающих эрибулин.
Диссеминированное внутрисосудистое свертывание крови
Сообщалось о случаях развития диссеминированного внутрисосудистого свертывания крови, обычно ассоциированного с нейтропенией и/или сепсисом.
Периферическая невропатия
Среди 1559 пациентов с раком молочной железы наиболее частым побочным явлением, приводящим к отмене терапии эрибулином, была периферическая невропатия (3.4%). Медиана до появления периферической невропатии 2 степени составила 12.6 недель (после 4 циклов). У 2 из 404 пациентов с саркомами мягких тканей периферическая невропатия привела к отмене терапии эрибулином. Медиана до появления периферической невропатии 2 степени составила 18.4 недель.
Развитие периферической невропатии степени 3 и 4 возникало у 7.4% пациентов с раком молочной железы и у 3.5% пациентов с саркомами мягких тканей. В клинических исследованиях было показано, что у пациентов с невропатией, имевшейся до начала терапии препаратом Халавен, не было большего риска развития новых или ухудшения уже имеющихся ее симптомов, в отличие от пациентов, не имевших периферической невропатии до начала терапии препаратом Халавен.
У пациентов с раком молочной железы с предшествующей периферической невропатией 1 или 2 степени частота возникновения периферической невропатии 3 степени при лечении препаратом Халавен составляла 14%.
Гепатотоксичность
У некоторых пациентов наблюдалось увеличение активности печеночных ферментов в начале лечения эрибулином (чаще всего в
В одном из случаев передозировки пациенту ошибочно было введено 8.6 мг препарата Халавен (примерно в 4 раза выше запланированной дозы), в результате чего развилась реакция гиперчувствительности 3 степени на 3-й день и нейтропения 3 степени - на 7-й. Обе нежелательные реакции разрешились при помощи поддерживающей терапии. Антидот при передозировке препаратом Халавен неизвестен.
Лечение: в случае передозировки рекомендуется постоянное наблюдение за пациентом и использование симптоматической терапии.
Лекарственная несовместимость
Данный препарат нельзя смешивать с другими лекарственными препаратами.
Раствор для инъекций Халавен не следует разводить в 5% растворе декстрозы для инфузий.
Эрибулин преимущественно (до 70%) экскретируется с желчью. Транспортный белок, отвечающий за этот процесс, не выявлен. Полное ингибирование транспорта может в теории привести к возрастанию плазменной концентрации более чем в 3 раза. В связи с этим, не рекомендуется одновременное с эрибулином применение препаратов (например, таких как циклоспорин, ритонавир, саквинавир, лопинавир, эфавиренз, эмтрицитабин, хинин, хинидин, дизопирамид и др.), являющихся ингибиторами печеночных транспортных белков (органического анион-транспортного белка (OATPs), Р-гликопротеина, белков множественной лекарственной резистентности (МRPs) и др).
Не рекомендуется одновременный прием с карбамазепином, фенитоином, зверобоем продырявленным, поскольку эти препараты могут привести к заметному снижению концентрации эрибулина в плазме и, соответственно, снижению его эффективности. При одновременном применении с рифампицином, являющимся индуктором изофермента CYP3A4, значимого влияния на фармакокинетические параметры эрибулина (AUC и Cmax) не наблюдалось. Однако рифампицин, вследствие своего свойства ингибировать транспортные белки, может нейтрализовывать свой индуцирующий эффект на выведение эрибулина. Поэтому эффект рифампицина не может быть экстраполирован на другие индукторы.
Лекарственное взаимодействие с ингибиторами изофермента CYP3A4 не ожидается. Клинически значимых различий в экспозиции эрибулина (AUC и Cmax) при его применении совместно с кетоконазолом (ингибитором изофермента СYP3А4 и Р-гликопротеина) не наблюдалось.
Влияние эрибулина на фармакокинетику других лекарственных средств
Согласно исследованиям in vitro, эрибулин может быть слабым ингибитором изофермента СYP3А4. При одновременном применении с лекарственными средствами, обладающими узким терапевтическим диапазоном и метаболизирующимися преимущественно изоферментом СYP3А4 (например, алфентанил, циклоспорин, эрготамин, фентанил, пимозид, хинидин, сиролимус, такролимус) следует проявлять осторожность и вести наблюдение за нежелательными явлениями.
Эрибулин не оказывает ингибирующего действия на изоферменты CYP1A2, CYP2В6, CYP2С8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 в терапевтическом диапазоне концентраций.
Гематологические
Миелосупрессия является дозозависимой и, в первую очередь, выражается в виде нейтропении (см. раздел "Побочное действие"). У каждого пациента перед введением любой дозы препарата Халавен следует провести клинический анализ крови. Лечение препаратом Халавен можно начинать только при АЧН выше 1.5×109/л и числе тромбоцитов выше 100×109/л.
Менее чем у 5 % пациентов, получающих Халавен, наблюдалась фебрильная нейтропения. При развитии у пациента фебрильной нейтропении, а также при тяжелой нейтропении или тромбоцитопении, следует скорректировать лечение в соответствии с рекомендациями, приведенными в разделе «Режим дозирования».
При активности АЛТ или АСТ, превышающей верхнюю границу нормы более чем втрое, у пациента повышается риск развития нейтропении 4 степени и фебрильной нейтропении. При значениях билирубина, превышающих верхнюю границу нормы более чем в полтора раза, также повышается риск развития нейтропении 4 степени и фебрильной нейтропении, хотя данные, подтверждающие эту зависимость, ограничены.
При тяжелой нейтропении по решению лечащего врача и в соответствии с действующими рекомендациями может быть назначен гранулоцитарный колониестимулирующий фактор (Г-КСФ) или его аналог.
Периферическая невропатия
Следует вести постоянное наблюдение за возможными признаками периферической моторной или сенсорной невропатии у пациентов. Развитие тяжелой периферической невропатии требует задержки введения или уменьшения дозы.
Пациенты с предшествующей периферической невропатией более чем 2 степени тяжести не включались в клинические исследования. Тем не менее, у пациентов с предшествующей невропатией 1 или 2 степени тяжести не наблюдался больший риск развития новых или ухудшения уже имеющихся ее симптомов в сравнении с пациентами, включенными в исследование без данного состояния.
Удлинение интервала QT
Удлинение интервала QT отмечалось на 8-й день, независимо от концентрации эрибулина и при нормальных значениях интервала в 1-й день. На фоне лечения препаратом Халавен мониторинг ЭКГ рекомендуется проводить у пациентов с сердечной недостаточностью и брадиаритмиями, а также при одновременном приеме лекарственных средств, удлиняющих интервал QT (в т.ч. антиаритмических I A и III классов). До начала лечения препаратом Халавен рекомендуется устранить электролитный дисбаланс (например, гипокалиемию, гипомагниемию), а на фоне лечения мониторировать содержание этих электролитов в крови.
Не рекомендуется назначать препарат Халавен пациентам, имеющим синдром врожденного удлинения интервала QT.
Использование в комбинациях
Установлено, что применение эрибулина в комбинации с анти-HER2 терапией и капецитабином является безопасным.
Вспомогательные вещества
Халавен содержит небольшое количество этанола (менее 100 мг на дозу).
Специальные меры предосторожности при утилизации и использовании
Подготовка и введение препарата может осуществляться исключительно лицами, имеющими соответствующий опыт работы с цитостатиками.
Халавен представляет собой цитотоксический противоопухолевый препарат и при работе с ним, как и с другими токсичными веществами, следует проявлять осторожность. Рекомендуется использовать перчатки, защитные очки и защитную одежду. В случае попадания раствора препарата на кожу, необходимо сразу же тщательно промыть этот участок кожи водой с мылом. При контакте препарата со слизистыми оболочками, место контакта необходимо тщательно промыть водой. При беременности не следует работать с препаратом Халавен.
Хранение вскрытой упаковки
С микробиологической точки зрения Халавен следует использовать немедленно после вскрытия. Если препарат не применяется сразу же после вскрытия упаковки, за сроки и условия его хранения отвечает лицо, работающее с препаратом.
Если Халавен не применяется сразу же после вскрытия упаковки в виде неразведенного раствора, максимальный срок хранения при 25 оС на рассеянном свету составляет 4 ч, а в условиях холодильника (2-8°С) – 24 ч.
Разведенный раствор препарата Халавен (в концентрациях от 0.02 мг/мл до 0.2 мг/мл в 0.9% растворе натрия хлорида для инъекций) может храниться не более 24 ч при температуре 2-8°С, за исключением тех ситуаций, когда разведение исходного раствора осуществлялось в стандартизованных контролируемых асептических условиях.
Неиспользованные остатки препарата и использованные материалы следует утилизировать согласно действующим в РФ требованиям.
Влияние на способность управлять транспортными средствами и работать с механизмами
При приеме препарата Халавен могут наблюдаться такие побочные эффекты как усталость или головокружение, которые могут оказывать слабое или умеренное воздействие на возможность управлять автомобилем или работать с механизмами. Пациентов следует информировать о том, что при появлении чувства усталости или головокружения им нельзя управлять автомобилем или работать с механизмами.
Беременность
Данных о применении препарата Халавен у беременных нет. В доклинических исследованиях эрибулин оказывал эмбриотоксическое, фетотоксическое и тератогенное действие. Халавен не следует применять при беременности.
Женщины фертильного возраста должны быть проинформированы о необходимости предохранения от беременности при использовании ими или их партнерами препарата Халавен, а также об обязательном применении эффективных методов контрацепции в период лечения препаратом Халавен и в течение 3 месяцев после его завершения.
Лактация
Данных о проникновении эрибулина или его метаболитов в грудное молоко человека или животных нет. Поскольку риск для новорожденных и грудных детей не может быть исключен, Халавен не следует применять в период грудного вскармливания.
Фертильность
В доклинических исследованиях наблюдалась тестикулярная токсичность препарата. До начала лечения пациентам мужского пола следует обратиться за консультацией по поводу консервации спермы, поскольку при лечении препаратом Халавен существует вероятность развития необратимого бесплодия.
По рецепту.
Хранить при температуре от 8° до 25°С. Не замораживать и не хранить в холодильнике. Хранить в недоступном для детей месте. Срок годности - 4 года.