Противоопухолевый препарат. Моноклональные антитела
Концентрат для приготовления раствора для инфузий в виде прозрачной или опалесцирующей, бесцветной или бледно-желтого цвета жидкости; после фильтрации через прилагаемый встроенный фильтр с диаметром пор 0.2 мкм видимые частицы должны отсутствовать.
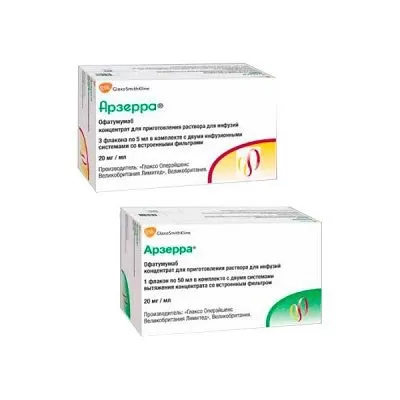
Активное вещество: офатумумаб 20 мг.
Вспомогательные вещества: натрия ацетата тригидрат - 6.8 мг, динатрия эдетат - 0.019 мг, полисорбат 80 - 0.2 мг, аргинин - 10 мг, натрия хлорид - 2.98 мг, хлористоводородная кислота - q.s. до pH 5.5, вода д/и - q.s. до 1 мл.
5 мл - флаконы стеклянные (3) в комплекте с двумя инфузионными системами со встроенными фильтрами диаметром пор 0.2 мкм, помещенными в пакет - пачки картонные. 50 мл - флаконы стеклянные (1) в комплекте с двумя инфузионными системами со встроенными фильтрами диаметром пор 0.2 мкм, помещенными в пакет - пачки картонные.
— лечение хронического лимфоцитарного лейкоза (ХЛЛ) при неэффективности ранее проводимой терапии с включением флударабина и/или алемтузумаба.
— тяжелые нарушения функции почек (КК < 30 мл/мин);
— беременность;
— период грудного вскармливания;
— детский и подростковый возраст до 18 лет;
— повышенная чувствительность к компонентам препарата.
С осторожностью: гепатит В в анамнезе, нарушение функции легких и заболевания сердца в анамнезе.
Офатумумаб необходимо вводить под наблюдением врача, имеющего опыт применения противоопухолевых препаратов. В связи с возможностью развития анафилактоидных реакций, инфузию офатумумаба стоит проводить в условиях немедленной доступности аппаратуры и медикаментов, необходимых для оказания экстренной помощи в таких ситуациях.
Препарат вводят в виде в/в инфузий. Перед применением препарат следует разводить. Концентрированный раствор следует смешивать только с 0.9% раствором натрия хлорида для в/в введения. Не рекомендуется смешивать офатумумаб в емкости для введения с другими препаратами.
Премедикация
За 30 мин-2 ч до введения офатумумаба больным необходимо провести премедикацию
Дозы
Рекомендованная доза составляет 300 мг офатумумаба для первого введения и 2000 мг офатумумаба — для всех последующих введений. Схема введения предусматривает 8 последовательных еженедельных введений, а 4-5 недель спустя — 4 последовательных ежемесячных (т.е. через каждые 4 недели) введения.
Изменение дозы и возобновление лечения
Развитие нежелательных реакций, связанных с введением офатумумаба, может вызвать необходимость снижения скорости введения.
В случае развития слабо или умеренно выраженных нежелательных реакций введение следует прекратить и, если состояние больного остается стабильным вновь возобновить со скоростью, равной половине той, на которой введение было прервано. Если к моменту прекращения введения офатумумаба из-за развития нежелательных реакций скорость не успела возрасти от исходной, равной 12 мл/ч, то при возобновлении введения его следует проводить со стандартной начальной скоростью, равной 12 мл/ч. В дальнейшем скорость введения, с учетом переносимости препарата больным и по усмотрению врача, можно увеличивать по стандартной схеме (так, чтобы скорость удваивалась не быстрее, чем через каждые 30 мин).
В случае развития серьезных нежелательных реакций введение следует прекратить и, если состояние больного остается стабильным, вновь возобновить со скоростью 12 мл/ч. В дальнейшем скорость введения, с учетом переносимости препарата больным и по усмотрению врача, можно увеличивать по стандартной схеме (так, чтобы скорость удваивалась не быстрее, чем через каждые 30 мин).
Коррекция дозы пациентам пожилого возраста не требуется.
1) Перед разведением офатумумаба
Перед разведением следует проверить концентрат офатумумаба на предмет наличия в нем частиц и изменения цвета. Не использовать офатумумаб, если его цвет изменен. Концентрат может содержать небольшое количество видимых частиц. Эти частицы будут удалены фильтрами, входящими в комплект для введения.
Не встряхивать флакон с офатумумабом перед проведением описанной проверки.
2) Как приготовить раствор для в/в введения
Перед введением концентрат офатумумаба необходимо развести в 0.9% растворе натрия хлорида для в/в введения в асептических условиях.
Доза 300 мг
Следует использовать 3 флакона (суммарно - 15 мл, по 5 мл во флаконе):
- из емкости с 0.9% раствором натрия хлорида для в/в введения объемом 1000 мл отобрать и удалить 15 мл;
- из каждого из 3 флаконов с офатумумабом отобрать по 5 мл концентрата (всего 15 мл) и ввести их в емкость с 985 мл 0,9% раствора натрия хлорида для в/в введения;
- не встряхивать емкость - перемешать содержимое путем осторожного переворачивания.
Доза 2000 мг из флаконов по 5 мл
Для получения дозы 2000 мг использовать 20 флаконов (суммарно - 100 мл, по 5 мл во флаконе): - из емкости с 0.9% раствором натрия хлорида для в/в введения объемом 1000 мл отобрать и удалить 100 мл; - из каждого из 20 флаконов с офатумумабом отобрать по 5 мл концентрата (всего - 100 мл) и ввести их в емкость объемом 1000 мл; - не встряхивать емкость - перемешать содержимое путем осторожного переворачивания.
Доза 2000 мг из флаконов по 50 мл
Для получения дозы 2000 мг использовать 2 флакона (суммарно - 100 мл, по 50 мл во флаконе): - из емкости с 0.9% раствором натрия хлорида для в/в введения объемом 1000 мл отобрать и удалить 100 мл; - из каждого из 2 флаконов с офатумумабом отобрать по 50 мл концентрата (всего - 100 мл) и ввести их в емкость объемом 1000 мл; - не встряхивать емкость - перемешать содержимое путем осторожного переворачивания.
3) Введение
Офатумумаб не следует вводить в/в быстро или болюсно. Для в/в введения используются прилагаемые к препарату инфузионные системы со встроенными фильтрами.
Концентрат офатумумаба для приготовления раствора для инфузий не содержит консервантов, поэтому его разведение следует проводить в асептических условиях. Приготовленный раствор для инфузий необходимо хранить при температуре не выше 25°С и использовать в течение 24 ч после приготовления. По истечении этого срока остатки раствора следует уничтожить.
Офатумумаб не следует смешивать или вводить одновременно с другими препаратами или растворами для в/в введения. Чтобы этого избежать, перед и после введения офатумумаба необходимо промыть систему для введения 0.9% раствором натрия хлорида.
Первое и второе введения
При первом и втором введении препарат следует вводить в течение 6.5 ч через инфузионную систему или через постоянный катетер. Начальная скорость введения препарата при первом и втором введении должна составлять 12 мл/ч. Во время введения его скорость следует постепенно увеличивать так, чтобы каждые 30 мин она удваивалась и возрастала до максимальной, равной 200 мл/ч.
Последующие введения
Если второе введение прошло без развития серьезных нежелательных реакций, остальные введения (3-12) следует проводить в течение 4 ч с начальной скоростью 25 мл/ч, которая должна постепенно возрастать, удваиваясь каждые 30 мин до максимальной, равной 400 мл/ч.
Передозировка
Результаты клинических испытаний не содержат каких-либо данных о случаях передозировки офатумумаба.
Лекарственное взаимодействие
Каких-либо исследований лекарственного взаимодействия между офатумумабом и другими препаратами не проводилось.
При совместном применении офатумумаба с препаратами, обладающими иммуносупрессивной активностью, возможно увеличение риска развития инфекционных заболеваний.
Со стороны органов кроветворения: нейтропения, анемия, фебрильная нейтропения, тромбоцитопения, лейкопения.
Со стороны иммунной системы: гиперчувствительность, анафилактические реакции, включая анафилактический шок.
Со стороны обмена веществ: синдром лизиса опухоли.
Со стороны сердечно-сосудистой системы: тахикардия, артериальная гипертензия, артериальная гипотензия.
Со стороны дыхательной системы: боли в гортанно-глоточной области, одышка, кашель, бронхоспазм, дискомфорт в области грудной клетки, заложенность носа, гипоксия.
Со стороны пищеварительной системы: тошнота, непроходимость тонкого отдела кишечника, диарея.
Со стороны кожи и подкожно-жировой клетчатки: сыпь, зуд, крапивница, приливы.
Вторичные инфекции: бронхит, пневмония, сепсис, септический шок, инфекция, вызванная вирусом Varicella zoster, инфекции мочевыводящих путей, прогрессирующая многоочаговая лейкоэнцефалопатия, гепатит В.
Общие реакции: усталость, озноб, гипергидроз, синдром выброса цитокинов, гипертермия, боли в спине.
Реакции на введение
При применении офатумумаба могут наблюдаться реакции на введение, требующие временного прекращения лечения или же его отмены. Ослабить реакции на введение может премедикация, однако даже в этом случае реакции могут развиваться, в основном, во время первого введения. Реакции на введение могут включать: анафилактические реакции, нежелательные явления со стороны сердечно-сосудистой системы, озноб, кашель, синдром выброса цитокинов, диарею, одышку, усталость, приливы, повышение или снижение АД, тошноту, боль, повышение температуры, сыпь и крапивницу. Случаи развития серьезных реакций на введение офатумумаба, включая синдром выброса цитокинов, были описаны даже при проведении премедикации. В случае развития серьезных реакций на введение следует немедленно приостановить введение препарата и провести симптоматическое лечение.
Чаще всего реакции на введение развиваются в день первого введения, а при последующих введениях их выраженность уменьшается. У пациентов с нарушением функции легких в анамнезе может быть повышен риск развития осложнений со стороны дыхательной системы, обусловленных развитием серьезных реакций на введение, поэтому во время введения офатумумаба за функцией дыхания необходимо тщательно следить.
Синдром лизиса опухоли
У больных с ХЛЛ при введении офатумумаба может развиваться синдром лизиса опухоли. Лечебные мероприятия в таких случаях включают коррекцию электролитного баланса, контроль функции почек, поддержание водного баланса и симптоматическое лечение.
Прогрессирующая многоочаговая лейкоэнцефалопатия
У пациентов с ХЛЛ, получающих лечение цитотоксическими препаратами, может развиваться прогрессирующая многоочаговая лейкоэнцефалопатия (ПМОЛЭП), в т.ч. приводящая к летальному исходу. Диагноз ПМОЛЭП следует исключать у всех больных,
которые сообщают о развитии у них неврологической симптоматики или об изменении характера неврологических симптомов, существовавших ранее. При подозрении на ПМОЛЭП лечение офатумумабом следует прекратить и обратиться за консультацией к неврологу.
Вакцинация
Безопасность вакцинации живыми ослабленными или инактивированными вакцинами и способность к развитию первичного или вторичного иммунного ответа на них во время лечения офатумумабом не исследовались. Поскольку количественное содержание В-клеток снижается, ответ на вакцинацию может быть ослаблен. Перед вакцинацией пациентов, проходящих курс лечения офатумумабом, необходимо оценить соотношение рисков и пользы вакцинации этих пациентов. В связи с наличием риска развития инфекции следует избегать введения живых ослабленных вакцин на протяжении или по окончании терапии офатумумабом до нормализации количества В-лимфоцитов.
Гепатит В
У пациентов, получающих офатумумаб, вследствие иммуносупрессивного эффекта терапии имеется повышенный риск инфицирования вирусом гепатита В (HBV) и его реактивации, которые могут, в т.ч., приводить к летальному исходу. Перед началом лечения офатумумабом следует выявить пациентов с высоким риском развития заболевания, вызванного HBV. У носителей HBV во время лечения офатутумабом и в течение 6-12 месяцев после его окончания необходимо тщательно следить за лабораторными и клиническими признаками развития активной инфекции HBV. Лечение офатумумабом тех больных, у которых развивается вирусный гепатит, следует прекратить и провести им соответствующую противовирусную терапию. Данных по безопасности применения офатумумаба у пациентов с активным гепатитом недостаточно для того, чтобы сделать определенный вывод.
Сердечно-сосудистые заболевания
За состоянием пациентов с заболеваниями сердца в анамнезе следует тщательно следить. Если у пациентов развиваются серьезные или угрожающие жизни нарушения ритма сердца, лечение офатумумабом следует прекратить.
Непроходимость кишечника
У пациентов, получавших лечение анти-СD20 моноклональными антителами, в частности офатумумабом, иногда отмечалось развитие непроходимости кишечника. Пациентов с жалобами на боли в животе, в особенности развивающиеся в начале курса лечения офатумумабом, необходимо обследовать и назначить им соответствующую терапию.
Лабораторное обследование
Поскольку офатумумаб связывается со всеми СD20-положительными лимфоцитами (как опухолевыми, так и нормальными), во время лечения офатумумабом необходимо через регулярные промежутки времени проводить контроль гемограммы; если у пациентов развивается цитопения, исследование следует делать чаще. При развитии цитопении необходимо проводить соответствующую терапию.
При нарушениях функции почек
Каких-либо специальных исследований фармакокинетики офатумумаба у больных с нарушением функции почек не проводилось. Тем не менее, маловероятно, что для пациентов с нарушением функции почек потребуется корректировать дозу препарата.
При нарушениях функции печени
Каких-либо специальных исследований фармакокинетики офатумумаба у больных с нарушением функции печени не проводилось. Тем не менее, маловероятно, что для пациентов с нарушением функции печени потребуется корректировать дозу препарата.
Влияние на способность к вождению автотранспорта и управлению механизмами
Исследований влияния офатумумаба на способность управлять автомобилем или работать на автоматическом оборудовании не проводилось. Исходя из фармакологических свойств офатумумаба, оснований подозревать неблагоприятное действие препарата на эти виды активности нет. При рассмотрении возможности пациента выполнять действия, требующие повышенной концентрации внимания и быстроты психомоторных реакций, следует учитывать клиническое состояние и профиль побочных реакций офатумумаба.
Беременность и лактация
Препарат Арзерра противопоказан при беременности и в период лактации (грудного вскармливания).
Применение в детском возрасте
Безопасность и эффективность офатумумаба у детей и подростков младше 18 лет не исследовалась.
Препарат следует хранить в недоступном для детей, защищенном от света месте, при температуре от 2°С до 8°С. Не замораживать. Срок годности - 3 года.
Препарат отпускается по рецепту.